Santé personnalisée
Vers une implication de la société ?
Rapport rédigé par Michael Balavoine
Une initiative de la Fondation Leenaards


Introduction
Issues des technologies portant sur la clinique, la biologie ou l’épidémiologie, les données ont déjà commencé à transformer la médecine. Mais ce qui s’annonce pour demain est une véritable révolution. C’est le crédo du mouvement de la santé personnalisée (ou médecine de précision), qui espère, en collectant, stockant et analysant toujours plus d’informations sur les individus et les populations, déterminer les risques de développer des pathologies et améliorer les modèles et les modalités de diagnostic, de prévention et de traitement. Mais quelles sont les implications sociales et humaines de ces évolutions qui vont changer, par le nouveau savoir qu’elles apportent, les conceptions de la maladie et de la santé ? Cette question, qui concerne l’ensemble des citoyen·ne·s, est trop souvent laissée de côté par les instances qui les financent et mettent en place leurs infrastructures. Focalisées sur les aspects techniques et économiques, elles tendent à minimiser les conséquences anthropologiques et sociétales de ces avancées.
En finançant dix projets de recherche-action, la production de plus de 300 articles, une collection de livres et de nombreux événements, l’initiative Santé personnalisée et société (SantéPerSo) de la Fondation Leenaards a cherché à stimuler une dynamique citoyenne et participative à propos des multiples implications et conséquences non médico-technologiques de la santé personnalisée.
Comme souvent dans le monde biomédical, la réflexion sur l’utilisation des technologies reste une affaire d’experts
Alain Kaufmann, directeur du ColLaboratoire de l’Université de Lausanne, projet ECOS
SantéPerSo a souhaité ajouter une dimension sociétale et humaine aux développements rapides des high-techs en médecine – en particulier le séquençage du génome, le big data, voire l’intelligence artificielle (IA) –, avec les risques et les bénéfices qui en découlent.
Pr Philippe Moreillon, président de la commission scientifique Leenaards
L’initiative « Santé personnalisée et Société » de la Fondation Leenaards c’est :
 Un fond de
1 million de CHF
Un fond de
1 million de CHF 10 projets
abordant les aspects cliniques, éthiques ou encore économiques de la santé personnalisée
10 projets
abordant les aspects cliniques, éthiques ou encore économiques de la santé personnalisée Une plateforme d’information et d’échange
pour appréhender facilement les enjeux de cette thématique
Une plateforme d’information et d’échange
pour appréhender facilement les enjeux de cette thématique
Santé personnalisée : de quoi parle-t-on ?
La définition de la santé personnalisée (ou de précision) ne fait l’unanimité ni chez les professionnel·le·s de santé ni chez les expert·e·s du domaine. Le concept en lui-même n’est pas nouveau. Il apparaît dans les années 1990, « alors que se concrétise l’idée de mieux comprendre les corrélations entre le profil génétique des patients et leur capacité à bien ou mal répondre à un traitement médicamenteux. »1 La démocratisation du séquençage du génome, tout comme les progrès fulgurants des autres « omiques », ont donné à la biologie une nouvelle dimension. D’un autre côté, depuis les années 70, avec l’avènement de la téléphonie mobile, de l’informatique personnelle, du web et plus récemment des réseaux sociaux, la société a connu une numérisation croissante. C’est la rencontre entre ces deux mondes, celui de la biologie et celui de la technologie, qui a permis l’émergence de la santé personnalisée. Avec l’accroissement du nombre de données liées à un individu, on nous promet de pouvoir trouver des modèles qui permettent de déterminer le risque qu’a une personne de développer une maladie, le meilleur moyen de la diagnostiquer ou de la traiter.
1 Médecine personnalisée ou impersonnalisée: entretien avec Samia Hurst et Xavier Guchet, par Olivier Dessibourg, Planète Santé éditions, 2018, vol 2/6, p. 25.
DÉFINITION
La santé personnalisée (ou de précision) est une approche qui prend en compte les préférences individuelles ainsi que la variabilité du génome, de l’environnement et du mode de vie pour adapter les interventions de prévention, les techniques de diagnostic et les stratégies de traitement afin d’améliorer les résultats pour la santé.
Frontliners.ch, teaching primary care to health care professionals
Idris Guessous, Gérard Waeber, Jacques Cornuz, Sissel Guttmorsen, Evrim Jaccard, Sharon Mitchell, Prune Collombet
Rôle des « omiques » dans la santé personnalisée
Génomique : étudie le fonctionnement d’un organisme, d’un organe, d’un cancer, etc. à l’échelle du génome, au lieu de se limiter à l’échelle d’un seul gène.
Transcriptomique : étudie l’ensemble des ARN messagers produits lors du processus de transcription d’un génome.
Protéomique : étudie l’ensemble des protéines d’une cellule, d’un organite, d’un tissu, d’un organe ou d’un organisme à un moment donné et sous des conditions données.
Métabolomique : étudie l’ensemble des métabolites primaires (sucres, acides aminés, acides gras, etc.) présents dans une cellule, un organe, un organisme.
Génotype : ensemble des gènes qui constituent un organisme. Le génotype n’est pas observable macroscopiquement.
Phénotype : ensemble des traits observables d’un organisme.
Les sources des données en santé
 E. Vayena, J. Dzenowagis, M. Langfeld, 2016
E. Vayena, J. Dzenowagis, M. Langfeld, 2016
En analysant de très grandes quantités de données, la santé personnalisée promet non seulement de prédire les maladies et de cibler les traitements mais aussi de renverser le modèle de la médecine conventionnelle. Ce dernier est basé sur la reconnaissance de symptômes couplée à l’administration d’un traitement générique pour une maladie donnée, mais pas obligatoirement ajusté aux particularités de chaque individu.
La santé personnalisée espère au contraire identifier très tôt les risques et adapter les traitements en fonction des particularités des individus.
Déconstruction, analyse et diagnostic
Cet exemple illustre comment la médecine de précision pourrait déconstruire les catégories traditionnelles basées sur les symptômes.
Les patient·e·s ayant des troubles de l’humeur font l’objet d’études sur la base de différents critères pour regrouper les syndromes hétérogènes actuels en groupes homogènes.
La théorie des 4P
Traditionnellement, les promesses de la santé personnalisée sont résumées par la théorie des 4P.
 Personnalisée
Personnalisée
Si elle est adaptée à la situation de chaque individu
 Prédictive
Prédictive
Si elle est capable de déterminer les risques pour la santé du·de la patient·e
 Préventive
Préventive
Si elle a le pouvoir d’éviter les maladies
 Participative
Participative
Si elle laisse à la personne le contrôle sur son état de santé et de bien-être et lui permet de devenir actrice de sa santé
La santé personnalisée pourrait aussi permettre de mener des politiques de santé publique plus ciblées sur les groupes fragiles en utilisant notamment des données de géolocalisation.
Apport de l’initiative
Informer et sensibiliser le grand public
Ce renversement du paradigme de la médecine conventionnelle concerne potentiellement l’ensemble de la population. Protection des données, coûts de la santé, accès aux thérapies ou encore rapport aux assurances : les questions que soulèvent les développements technologiques de la santé personnalisée sont nombreuses. Or, malgré les enjeux juridiques, culturels et anthropologiques que ces questions soulèvent et les espoirs que le concept suscite, il s’avère que la santé personnalisée est encore largement méconnue du grand public. Dans le cadre de l’initiative SantéPerSo, outre la production de nombreux articles et l’organisation d’événements grand public sur le sujet, deux projets ont sensibilisé la population à ce qu’est la santé personnalisée et quels en sont les enjeux.
1.Le bus « À notre santé ! » a présenté pendant trois mois une exposition immersive et interactive. Il a sillonné la Suisse romande de septembre à novembre 2019. Les visiteurs et visiteuses ont pu tester des outils de mesure de soi et expérimenter comment la médecine de demain pourra offrir un diagnostic, des traitements ou des recommandations de santé plus adaptés et personnalisés. Les visiteurs et visiteuses ont également été amené·e·s à prendre conscience des défis tant sociétaux qu’éthiques de la santé et de la médecine personnalisées, par exemple dans le cadre de la protection des données des personnes, des relations aux assurances, à l’État, voire à l’employeur. Le bus a été inauguré le 3 septembre 2019 sur la plaine de Plainpalais à Genève. Il s’est ensuite arrêté à Yverdon-les-Bains, Neuchâtel, Delémont, La Chaux-de-Fonds, Fribourg, Bulle, Vevey, Payerne, Renens et Martigny.
2.Une équipe de journalistes scientifiques a produit pour la chaîne locale Canal 9 une émission de 26 minutes autour de la santé personnalisée. En suivant deux patientes atteintes d’un cancer, l’émission montre comment des équipes interdisciplinaires équipées de technologies de pointe apportent dans des tumor boards des réponses adaptées au génome des malades. Quatre capsules (Tumor board, Institut de pathologie, Bioinformatique et Modélisation Moléculaire, La Bioinformatique en oncologie) ont également été réalisées et diffusées dans des classes du secondaire.
Applications concrètes : la génétique
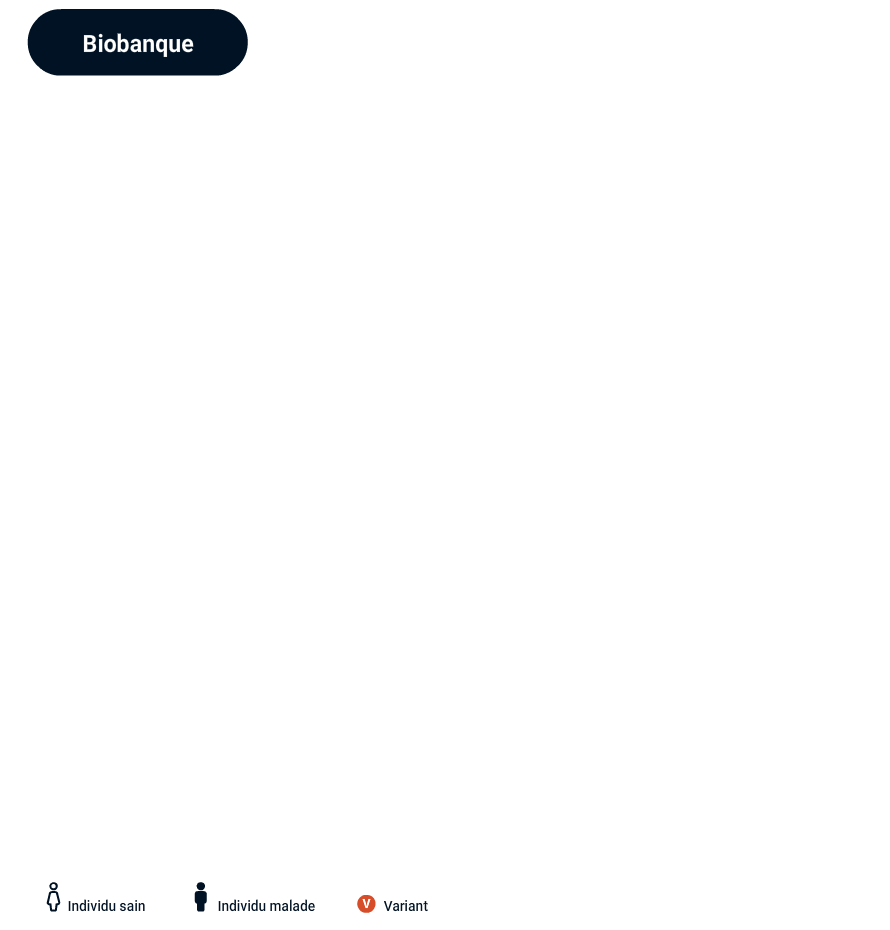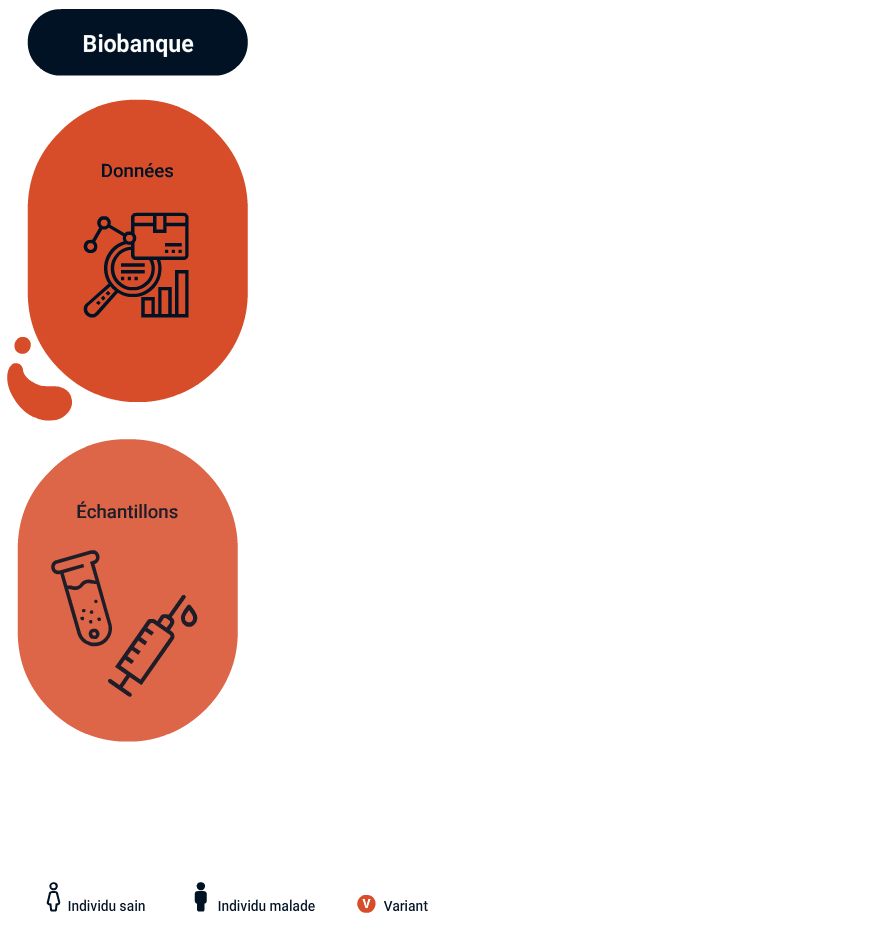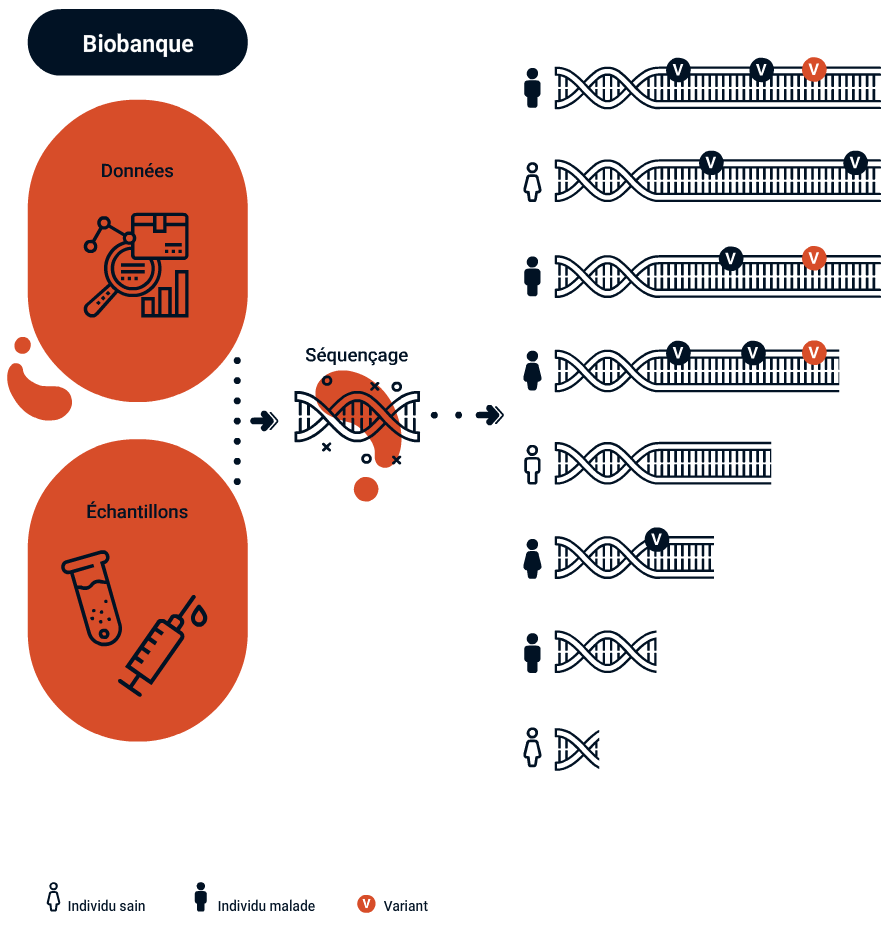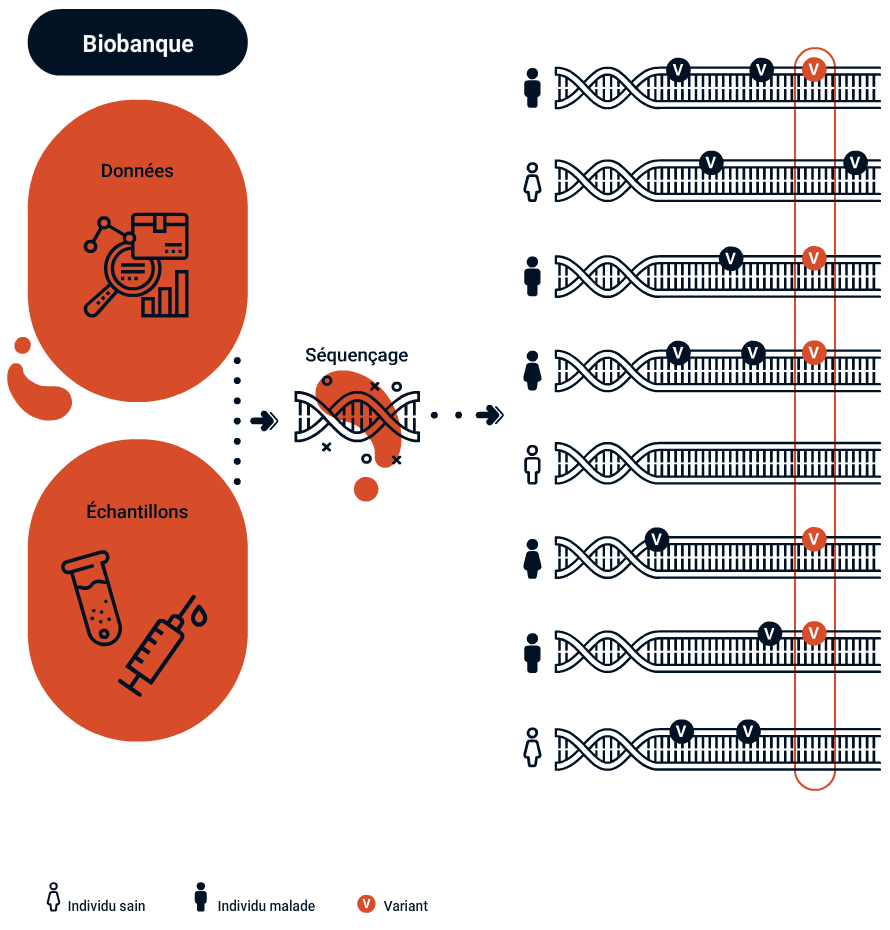
Le concept de santé personnalisée trouve une de ses origines dans une avancée spectaculaire, celle du séquençage complet du génome humain réalisé pour la première fois en 2002. Cette prouesse technologique aura demandé à plus de deux mille chercheurs dix ans de travail et aura coûté un milliard de dollars. Séquencer son génome coûte aujourd’hui moins de 100 dollars et prend moins de vingt-quatre heures. Les capacités de calcul ont ainsi ouvert la voie à un nouvel eldorado : comprendre la signification de cette immense suite de lettres qui compose notre code génétique. Ou plus exactement ses variations (ou SNP pour « single nucleotide polymorphisms » en anglais). Car c’est bien là l’intérêt du séquençage génétique : trouver quelles mutations sont importantes dans la survenue d’une maladie.
Le génome n’est en effet pas exactement le même pour tous les individus. Chacun·e d’entre nous possède de petites variations qui expliquent en partie nos différences de taille et d’apparence. Si la plupart sont bénignes, certaines peuvent toutefois être impliquées dans des maladies. Lorsqu’une personne présente des symptômes indiquant la présence d’une maladie génétique spécifique, un test génétique classique peut apporter une réponse. Lorsque l’on souhaite connaître la prédisposition à un tableau clinique plus complet (maladies cardiovasculaires par exemple), on peut réaliser une étude d’association pangénomique (Genome Wide Association Study, GWAS). Une GWAS consiste à analyser les SNP appartenant aux génomes d’un grand nombre de personnes différentes et à les comparer entre eux.
Résumé
Le séquençage à haut débit de l’ADN produit :
1.Un grand nombre de mutations susceptibles d’expliquer la maladie.
2.Des variants génétiques de signification inconnue (VUs).
3.Des mutations génétiques qui prédisposent ou sont potentiellement la cause de maladies dont le·la patient·e n’a pas conscience et qui n’ont pas été recherchées (résultats inopinés).
Identifier les variants corrélés à une pathologie
DÉFINITIONS
La génétique est une discipline qui étudie l’hérédité, soit la transmission d’un caractère (ou d’une maladie) d’une génération à une autre. Elle se focalise essentiellement sur l’étude des gènes, en particulier sur leur association à des maladies et à leur traitement.
La génomique est une discipline plus récente, qui s’intéresse à l’entier du génome avec ses 20’000 gènes. En particulier, la génomique étudie comment la combinaison des variants dans des gènes différents peuvent interagir et ainsi déterminer la prédisposition aux maladies plus communes comme le diabète, l’obésité, l’hypertension et beaucoup d’autres.
Source : mongenome.ch
D’ici peu, séquencer son génome sera une démarche incontournable du dossier médical de chacun.
Stylianos Antonarakis, in Olivier Dessibourg, ADN, oracle de ma santé ?, Planète Santé éditions, 2018.
Avec quelle fréquence vous rendez-vous aujourd’hui chez le médecin si vous êtes en bonne santé ? Aux États-Unis, la moyenne est tous les deux ans. Or, ce chiffre a été fixé totalement arbitrairement… En ira-t-il de même avec le génome ? Avec quelle fréquence devra-t-on procéder à une réinterprétation d’un séquençage personnel en fonction des nouvelles découvertes en génétique ? C’est extrêmement difficile à estimer aujourd’hui.
Michael Snyder, in Olivier Dessibourg, ADN, oracle de ma santé ?, Planète Santé éditions, 2018.
DÉFINITION
Fruit de la rencontre entre la génétique et la pharmacologie, la pharmacogénomique permet d’adapter la substance ou la dose à administrer en fonction des caractéristiques génétiques des patient·e·s. Elle cherche à identifier, au moyen d’un test génétique, les patient·e·s pour qui un médicament spécifique serait particulièrement profitable ou à détecter les patient·e·s qui, en raison de leur patrimoine génétique, présentent un risque prévisible d’apparition d’effets secondaires non souhaitables ou même toxiques provoqués par ces médicaments.
Apport de l’initiative
Permettre un choix éclairé en matière de génétique

Technologiquement, séquencer le génome est certainement une des plus grandes réalisations humaines. Avec toutefois une complexité qu’on ne rencontre pas avec d’autres tests cliniques : grâce au séquençage du génome, on peut découvrir des risques futurs, non recherchés pour eux-mêmes et qui, selon des probabilités peu sûres, se réaliseront ou ne se réaliseront pas. Difficile, dans ces circonstances, de se faire une opinion, comme patient·e, mais aussi plus globalement comme citoyen·ne, sur le ratio risque/bénéfice de l’analyse du génome. Que disent ces résultats ? Comment les restituer aux personnes concernées ? Comment se préparer à les accueillir ? Sont-ils à considérer comme une information permettant de mieux gérer son quotidien et de mieux planifier l’avenir ou, au contraire, comme une menace anxiogène à laquelle il est potentiellement difficile de faire face ? Dans le cadre de l’initiative SantéPerSo, Jacques Fellay, Idris Guessous et Evrim Jaccard ont développé un outil pédagogique destiné aux citoyen·ne·s pour que chacun·e puisse se faire une opinion sur la démarche à suivre. Baptisé mongenome.ch, l’outil a été réalisé suite à un focus groupe. Il propose une rubrique interactive, Savoir ou pas, qui permet au visiteur·euse de s’orienter dans les contenus du site qui sont le plus appropriés pour lui·elle. Des podcasts, des infographies ainsi que des articles donnent ensuite aux personnes concernées des informations neutres pour se déterminer dans le choix d’effectuer ou non une démarche de séquençage génétique.
Du point de vue du monde professionnel, la réalisation de ce projet a été un élément clé de l’établissement d’un carrefour collaboratif entre de multiples entités : l’Unité de médecine de précision et le Service de Médecine de premier recours aux HUG, le service de Communication au CHUV, le ColLaboratoire de l’UNIL, l’Unité Consentement général au CHUV et le Service de Médecine génétique au CHUV. Ce réseau est un point d’ancrage des futurs projets relatifs à la génomique et à la santé personnalisée.
Ce qui est compliqué, c’est que les résultats d’une analyse du génome peuvent être déconnectés d’un tableau clinique précis. Dans la plupart des cas, quand vous allez voir le médecin, vous avez une plainte spécifique, avec des symptômes associés. Vous cherchez une réponse à une souffrance que vous avez identifiée. Le séquençage génomique ouvre des perspectives plus larges. Il permet d’identifier plusieurs variants génétiques, des mutations, qui peuvent diagnostiquer, voire prédire une maladie. Seule une fraction de ces variants ont finalement une signification clinique. Mais en réalisant cette analyse, vous pouvez trouver plusieurs affections potentielles que vous ne cherchiez pas forcément au départ. L’information à restituer est plus difficile à calibrer quand il y a de multiples risques à prendre en considération.
Dr Evrim Jaccard à propos du séquençage génétique
Apport de l’initiative
Oncogénétique et "Vie longue" : l’Homo geneticus des forums citoyens
L’oncologie est certainement le domaine qui est le plus en vue en matière de santé personnalisée. En comprenant de mieux en mieux les processus de la maladie, les thérapies ciblées se multiplient. À tel point que les caractérisations génomiques détaillées des tumeurs sont en train d’induire la définition d’une nouvelle taxonomie des cancers chez l’être humain, qui complémentera l’actuelle classification basée sur l’histologie, soit l’étude des seuls tissus. Selon le Pr Pierre-Yves Dietrich, médecin-chef du Département d’oncologie des Hôpitaux universitaires de Genève, « au lieu de regrouper les malades par type de cancer (sein, poumons, prostate, etc.), on va les considérer en fonction du profil génétique de leur tumeur, indépendamment de l’organe que celle-ci affecte » (in Olivier Dessibourg, Médicaments ciblés et tests associés, clés de la médecine de précision, Planète Santé éditions, 2018).
Mais au-delà des espérances de traitement, comment les citoyen.ne.s jugent ces avancées ? Ces nouveaux traitements risquent-ils d’accroître les inégalités sociales ou de ne pas répondre aux besoins concrets de la population ? Dans le cadre de l’initiative SantéPerSo, Claudine Burton-Jeangros, Pierre Chappuis, Samia Hurst, Petros Tsantoulis et Monica Aceti ont organisé plusieurs forums citoyens autour de ces questions. Les forums ont rassemblé 73 personnes. À travers l’imagination de « mondes merveilleux » et de « mondes affreux », les participant·e·s ont interrogé leurs conceptions de la maladie et les changements que pourrait y apporter cette médecine du futur que promet la santé personnalisée. Trois niveaux d’analyse ont été repérés chez les citoyen·ne·s : la molécule, l’individu et le social. Les chercheur·euse·s ont identifié, à partir des propos échangés dans les forums, un individu idéal de ce nouveau monde. D’après leurs analyses, celui-ci anticipe le futur, modifie son style de vie et s’auto-contrôle tout en partageant ses données avec le collectif. « L’analyse des données a éclairé le processus de médicalisation des vies et d’implication active du sujet dans des choix préventifs et responsables, avec pour ligne de mire la “vie longue” et nous a conduit à une figure idéale d’individu que nous proposons d’appeler Homo geneticus »2, écrivent les expert·e·s dans un article. Cette figure de l’Homo geneticus, proposée ici à titre d’outil d’analyse, présente les caractéristiques suivantes2 :
1.L’Homo geneticus s’appuie sur sa carte d’identité génétique et la connaissance de ses prédispositions aux maladies pour prendre des décisions et agir.
2.Il opère de manière responsable la surveillance de ses prédispositions à des maladies et agit de manière préventive en suivant les indications thérapeutiques les plus récentes.
3.Il adapte son style de vie à ses données génétiques personnelles.
4.Il fait confiance au mode d’emploi personnalisé proposé par sa carte d’identité génétique, ce qui lui permet de vivre sans souci du lendemain.
5.Il partage ses données personnelles dans le but de bénéficier des avancées de la science participative.
6.Il participe à des programmes de dépistages génétiques préventifs, afin de réduire les risques populationnels de maladies génétiques, métaboliques, chroniques, etc.
7.Il a pour valeur idéale la prolongation de la vie en bonne santé, selon la notion de « la vie longue ».
2 Aceti M., Tsantoulis P., Chappuis P., Hurst-Majno S., Burton-Jeangros C., «Imaginaires associés aux avancées de la génétique et "médecine du futur" : le monde merveilleux de l’homo geneticus ? Une analyse par forums citoyens», Revue Áltera, Revista de Antropologia, João Pessoa, v. 1, n. 10, p. 90-128, jan./jun. 2020
Recherche : un nouveau paradigme
Dans le domaine de la recherche en santé personnalisée, la masse des données à disposition joue un rôle primordial. Historiquement, le développement de la recherche médicale a toujours commencé par une découverte de base, suivie d’une confirmation biologique de la cible, et culminé dans le test d’un médicament à travers des cohortes. Le médicament est ensuite administré à de larges parts de la population, sans qu’on sache s’il est vraiment efficace pour l’ensemble de la population visée. C’est le fameux « one size fits all ». Or, les données promettent de transformer ce processus : en analysant de très grandes sources d’informations, par exemple à l’aide de l’intelligence artificielle, on espère trouver des « patterns » communs à des petits groupes d’individus et ainsi rendre les traitements bien plus performants qu’ils ne le sont aujourd’hui pour les personnes concernées. L’objectif est donc de récupérer un maximum de données pertinentes à partir de chaque patient·e, et surtout ensuite de mettre celles-ci en réseau pour arriver à un traitement individualisé.
Aujourd’hui, le taux de réponse moyen aux traitements existants, toutes maladies confondues, est très faible. Pour près de la moitié des patient·e·s, le médicament qui leur est prescrit ne fonctionne pas mieux qu’un placebo (un produit dénué de principe actif).
Pr Antoine Geissbuhler, vice-recteur de l’UNIGE, Magazine Campus, septembre 2019
Qualité, interopérabilité, compétences : de nombreux défis entourent cette accumulation inédite de données. Pour y faire face au niveau suisse, une initiative intitulée Swiss Personalized Health Network (SPHN) a été lancée par l’Académie suisse des sciences médicales (ASSM) et le Swiss Institute of Bioinformatics (SIB). Elle regroupe des compétences (par exemple la bioinformatique clinique), des méthodes (par exemple les technologies omiques) et des infrastructures (par exemple les biobanques), tout en créant des hiérarchies communes pour les données omiques et les données cliniques des patient·e·s. Ainsi, en Suisse romande, le CHUV, les HUG, l’EPFL et les universités de Genève et Lausanne se sont regroupés sous l’appellation Lac Leman Center for Personalized Health. L’Université de Berne a rejoint ce groupe. À Zurich, un centre de compétences pour la médecine personnalisée a vu le jour au sein de la médecine universitaire (ETHZ, UZH, USZ), auquel s’est associée la Personalized Health Platform Basel (UniBas, USB).
Des traitements sur mesure grâce à l’analyse de données
Il existe beaucoup de déterminants cachés, liés à des multitudes de facteurs, dont certains sont propres à une population, qui influencent les nombreux paramètres de santé. Contrairement aux idées reçues, les données pourraient remettre au goût du jour un aspect fondamental de la médecine: celui d’être une connaissance globale, mais un art local. La recherche des déterminants de santé qui nous échappent – soit parce que les études sont menées in vitro, soit parce qu’elles se basent sur des données qui ne correspondent pas à la population concernée – n’a rien à voir avec un bricolage local. Au contraire: il s’agit d’une véritable avancée médicale.
Pr Christian Lovis, Médecin-chef du Service des sciences de l’information médicale des HUG, Revue Médicale Suisse, janvier 2020.
Apport de l’initiative
Une nouvelle forme citoyenne de consentement pour la recherche
Utiliser les gisements de mégadonnées à des fins de recherche est une condition de base de la santé personnalisée. Mais pour que ces données soient accessibles aux chercheurs·euses, encore faut-il que les personnes donnent leur consentement à leur transmission ou à celle d’échantillons biologiques. Aujourd’hui, le consentement est général : il donne la possibilité à chacun et chacune de donner son accord une seule fois pour toutes les recherches à venir. Problème ? Une possible perte de transparence. Comment le faire évoluer vers un modèle plus interactif ? Et surtout : comment l’étendre aux citoyen·ne·s et plus seulement aux patient·e·s ? C’est toute l’ambition de Smartconsent, un projet co-financé par l’initiative SantéPerSo et mené par Caroline Samer, responsable de l’Unité de pharmacogénomique des HUG, et Christian Lovis, chef du Service des sciences de l’information médicale des HUG. En utilisant la technologie de la blockchain, l’objectif est de créer une nouvelle vision du consentement qui soit dynamique et révocable. L’idée de cette nouvelle forme de consentement est de pouvoir moduler les choix au cours du temps et de faciliter la procédure de révocation. Les personnes décident ce qu’elles partagent et avec qui. Elles peuvent par ailleurs suivre une étude et en connaître les résultats. Cette démarche favorise un échange d’informations proactif entre fournisseurs et utilisateurs de données. L’ambition de ce projet est ainsi de renforcer la transparence et la traçabilité de tous ces processus dont la responsabilité devrait être mieux partagée entre citoyen·ne·s et chercheurs·euses. Une première version de l’outil est fonctionnelle depuis mars 2021 et un projet pilote devrait être mené au CHUV d’ici 2022.

Apport de l’initiative
Décision partagée, un rôle pour le médecin généraliste ?
Dans le cadre de la santé personnalisée, le rôle des médecins généralistes, et plus généralement de la première ligne de soins, est peu abordé. Or, avec la progression technologique, les maladies concernées dépassent de plus en plus les seules maladies dites rares, génétiques ou oncologiques pour englober maintenant celles dites silencieuses que sont les maladies chroniques comme le diabète. Dans ce contexte, les médecins généralistes ont un rôle majeur à jouer auprès des patient·e·s et des citoyen·ne·s qui voudraient effectuer un profil génétique.
En Suisse romande, une enquête inédite menée par Christine Cohidon, Jacques Cornuz, Béatrice Desvergne, Idris Guessous, Daniela Cerqui et Daniel Widmer s’est intéressée à la compréhension et à la perception qu’ont les médecins généralistes et leurs patient·e·s de la santé personnalisée. Ils se sont demandés, entre autres, quelles étaient les attentes des patient·e·s dans le domaine et comment celui-ci allait impacter la pratique de la médecine de premier recours.
Après des entretiens exploratoires, un questionnaire a ainsi été établi. 912 patient·e·s de 28 cabinets médicaux ont répondu. Avec les résultats principaux suivants :
57%
des participant·e·s affirmaient ne pas avoir entendu parler de la possibilité d’accéder à son profil génétique de risque.
78%
des patient·e·s souhaiteraient discuter avec leur médecin généraliste avant de décider de faire le test.
58%
pense ne pas être en mesure de comprendre les résultats des tests seul·e·s, sans l’aide d'un·e professionnel·le.
92%
des patient·e·s souhaiteraient discuter des résultats avec un·e professionnel·le.
Les expert·e·s concluent de cette enquête que :
La démarche [génétique] est actuellement connue par environ 4 patient·e·s sur 10. Cependant, une majorité d’entre eux·elles semblerait finalement intéressée à faire un test et l’inquiétude potentiellement résultante, aussi bien dans l’attente des résultats que dans la gestion d’un risque élevé de maladie, ne semble pas majeure. En revanche, dans de telles circonstances, un changement de comportement est clairement envisagé par les patient·e·s, aussi bien dans leur mode de vie que dans leur utilisation du système de santé. Enfin, les patient·e·s accordent une place majeure au médecin généraliste à toutes les étapes de la démarche, depuis l’intention de faire un test (à discuter avec leur médecin) jusqu’à des changements de prise en charge attendus en cas de risque élevé de maladie.
Le groupe a ensuite mené une enquête de type Delphi3 auprès de médecins généralistes et de jeunes médecins en formation pour recueillir leurs avis sur la santé personnalisée. Ils en concluent que :
• la médecine générale a un rôle de première ligne à jouer en matière d’accès au profil de risque génétique ;
• le·la patient·e devrait pouvoir compter sur le·la médecin généraliste comme ressource clé dans ce domaine et lui confère un rôle majeur pour faire face à l’impact psychologique d’une annonce de risque augmenté de maladies ;
• la santé personnalisée ne rendra pas le médecin "inutile" mais sera un outil supplémentaire à sa disposition ;
• les besoins en formation sont extrêmement importants dans le domaine de la santé personnalisée ;
• un encadrement des pratiques est nécessaire. Un cadre légal devrait notamment assurer la protection des données génétiques, notamment vis-à-vis des assureurs.
3 Les enquêtes Delphi, menées auprès d’acteurs concernés par la question étudiée (qualifiés d’ « experts ») permettent de rassembler des points de vue sur des tendances complexes et de les discuter afin de tendre vers un consensus.
Ce que montre finalement cette enquête, c’est que les autorités et les centres de compétences se sont concentrés sur les infrastructures techniques pour analyser le génome. Elles sont aujourd’hui à disposition. Il manque par contre des professionnel·le·s qualifié·e·s pour restituer l’information génomique et pour la partager avec les patient·e·s. Si on passe à du séquençage à grande échelle et que la pratique devient une routine clinique, les seul·e·s qui pourront faire face à la demande sont les soignant·e·s de premier recours, qu’il s’agisse des internistes généralistes, des pharmacien·ne·s ou des infirmier·ière·s. Or, cette première ligne de soins est mal préparée pour discuter de ces questions avec les patient·e·s. Il faut donc mettre en place des projets qui préparent les professionnel·le·s de santé à cette médecine des « omiques ».
Apport de l’initiative
Risques et limites autour de la santé personnalisée
Avec le projet « L’humain sur mesure », l’initiative SantéPerSo a participé à un grand débat national sur la thématique. En Suisse romande, un questionnaire a récolté les avis de 360 participant·e·s sur leurs espoirs et leurs craintes vis-à-vis de cette médecine du futur. Quatre débats ont également été organisés dans des villes de Suisse romande. Il est ressorti de ces interactions les conclusions suivantes4 :
1Le droit de ne pas savoir
La santé personnalisée étant basée sur l’utilisation de données génétiques, elle peut révéler des prédispositions à des problèmes de santé avant même qu’une maladie ne se déclare..
L’éventuel fossé entre l’information au sujet d’une maladie et le manque d’options de traitement est une question sensible.
Face à ces incertitudes, un droit de ne pas savoir doit être garanti, même si la frontière entre maladies traitables ou non peut être fine.
2Le coût du progrès
En personnalisant les traitements pour permettre le développement de thérapies pour de plus petits groupes de patient·e·s atteint·e·s de maladies relativement rares, on risque de voir le coût de développement de ces nouveaux médicaments augmenter. Entre 2002 et 2014, la FDA américaine a approuvé de nouveaux médicaments contre le cancer pour une valeur de 45 milliards de dollars pour une survie médiane de 2.7 mois.
Mieux prévenir les maladies et avoir des traitements plus efficaces pour des populations ciblées devrait d’un autre côté permettre de moins dépenser sur les problèmes à long terme.
3L’incertitude comme base de la solidarité
Le système des caisses-maladie repose sur des probabilités et des incertitudes : peu de gens sont en mesure de payer de leur propre poche le traitement d’une maladie grave et c’est la crainte d’une telle maladie qui les encourage à payer régulièrement leurs primes d’assurance. La possibilité d’évaluer la probabilité d’être touché·e par une maladie grâce aux tests génétiques pourrait affaiblir la base du système actuel, dans lequel les personnes en bonne santé co-financent les traitements médicaux des malades.
Les tests deviendront-ils obligatoires pour pouvoir être assuré·e ? Les assurances adapteront-elles leurs primes et prestations en fonction des résultats des tests ? : La valeur accordée à la solidarité est telle que les répondant·e·s considèrent qu'elle doit être préservée même si une personne connait son risque de maladie suite à un test génétique.
4 Les points sont tirés de la communication de l’Académie des sciences sur le projet Humain sur mesure : La santé personnalisée en discussion, Swiss Academies Communications, Vol. 15, No. 5, 2020.
Apport de l’initiative
Implication citoyenne dans les technologies5
Conçu par le ColLaboratoire de l’UNIL, en collaboration avec l’Unité de médecine de précision du CHUV et la Swiss Biobanking Platform, le projet « Espace de convergence des savoirs sur la santé personnalisée » (ECOS) a eu pour objectif de rassembler des chercheurs·euses actif·ve·s dans le domaine, des médecins de premier recours et des citoyen·ne·s afin qu’ils·elles confrontent leur vision au cours d’ateliers innovants d’interaction sociale.

5 Pour le détail de cette section, lire le rapport complet de Gaïa Barazzetti et d’Alain Kaufmann : Rapport du projet ECOS : Espace de convergence des savoirs sur la santé personnalisée, juillet 2020.
Les expert·e·s sont arrivé·e·s notamment à la conclusion que :
Le projet a permis de produire collectivement des définitions ancrées dans le vécu et les connaissances des participant·e·s concernant la signification de la « personnalisation », que l’on peut situer entre une personnalisation moléculairegénomique ou numérique, d’une part, et une personnalisation psycho-sociale, d’autre part (liée à la trajectoire biographique de chacun·e, à son réseau social incluant les proches et les soignant·e·s, etc). Ces visions et conceptions de la personnalisation, qui sont aussi des demandes et propositions faites par le groupe des citoyen·ne·s aux autres acteurs impliqués dans le projet, ont pu paraître « horssujet » à certain·e·s expert·e·s. Or, c’est précisément la propriété de l’approche participative utilisée dans le cadre du projet Espace de convergence des savoirs (ECOS) sur la santé personnalisée - qui rassemble des collèges de citoyen·ne·s, de chercheurs·euses, et de médecins généralistes - que de ne pas imposer une définition, un cadrage, qui serait celui défini exclusivement par les expert·e·s ou les chercheurs·euses spécialisé·e·s dans le domaine de la médecine personnalisée. Ce que montre le projet ECOS par ses riches et multiples résultats est la nécessité de disposer d’un espace au sein duquel les différents groupes sociaux, métiers et acteurs de la santé puissent confronter leurs visions et se mettre d’accord sur leurs divergences et convergences. La « robustesse sociale » des développements dans le domaine de la santé personnalisée ne sera pas acquise tant que nous ne multiplierons pas ces dispositifs d’intelligence collective dont le projet ECOS est un exemple innovant.
Un autre apport majeur du projet a été de montrer comment des expériences participatives permettent la montée en compétences et en capacités des acteurs, en d’autres termes leur « capacitation ». Ce néologisme, dérivé du terme anglais empowerment, indique l’acquisition de nouvelles connaissances, de compétences pratiques et de savoirs d’expérience par les participant·e·s à la recherche. Cette capacitation a été la plus marquée pour le Collège des Citoyens qui, à la suite de ces travaux et réflexions, a décidé de continuer à explorer la dimension relationnelle du soin comme mesure de la qualité du système de santé et du partenariat entre les patientes, patients, et le personnel de santé.
CONCLUSION
Outre sensibiliser la population au concept de la santé personnalisée, l’initiative de la Fondation Leenaards aura permis d’enclencher au moins trois dynamiques inédites en Suisse romande :
1.Une première impulsion, sociale, est d’avoir démontré la nécessité de disposer d’un espace au sein duquel les différents groupes sociaux, métiers et acteurs de la santé puissent confronter leurs visions et se mettre d’accord sur leurs divergences et convergences en matière de technologie. L’expérience de l’Espace de convergence des savoirs (ECOS) qui a rassemblé et fait discuter ensemble des collèges de citoyen·ne·s, de chercheurs·euses, et de médecins généralistes sur la question de la santé personnalisée montre qu’aujourd’hui, on ne peut plus concevoir des innovations biomédicales de grande ampleur sans impliquer davantage leurs futurs usagers dans l’exploration de leur pertinence sociale. Trop souvent, la technologie reste encore une affaire d’experts. Suite à l’initiative SantéPerSo, des porteurs de différents projets lauréats ont rédigé un « Policy paper » visant à renforcer la participation citoyenne à la discussion sur les technologies.
2.La deuxième impulsion a été de faire émerger le rôle d’un groupe — celui des médecins généralistes et plus largement celui de la première ligne de soins — dans le domaine de la santé personnalisée. Oublié·e·s du domaine, ces professionnel·le·s de santé sont pourtant essentiel·le·s dans le développement de cette médecine du futur. Car si les infrastructures sont quasiment prêtes, il manque le liant pour proposer et restituer à grande échelle le résultat produit par ces nouveaux outils aux personnes concernées. Les seul·e·s susceptibles d’assumer cette tâche en routine clinique sont les professionnel·le·s de la première ligne de soins.
3.Finalement, en choisissant un domaine interprofessionnel - un « objet frontière » comme les appellent les sociologues et historien·ne·s des sciences et des techniques - l’initiative a également permis aux porteurs·euses de projet de s’aventurer dans des chemins qu’ils·elles n’ont pas l’habitude d’explorer. De cette manière, ils·elles ont pu nouer des relations interdisciplinaires originales qui promettent de nombreuses innovations, y compris sociales, pour le futur.
Tous droits réservés © 2021 -
Conception : M&H Communication